[高考化学选择题秒杀技巧]2017高考化学选择题五大技巧(内附例题)
【#高考# 导语】寒窗苦读十余载,今朝考试展锋芒;思维冷静不慌乱,下笔如神才华展;心平气和信心足,过关斩将如流水;细心用心加耐心,努力备考,定会考入理想院校。以下是®文档大全网为大家整理的 《2017高考化学选择题五大技巧(内附例题)》供您查阅。
技巧1 列举特例 速排选项
高考选择题往往考查一般规律中的特殊情况,这就要求考生熟悉特例,对于一些概念判断、命题式判断正误类题目,如果从正面不能直接作出判断,可以列举反例、特例,迅速判断选项正误。
例题1 下列判断正确的是( )
A.没有单质参加或生成的反应一定不是氧化还原反应
B.酸性氧化物一定不能与酸反应
C.能使溴水褪色的有机物一定含有碳碳双键或碳碳叁键
D.酸、碱、盐、氧化物和单质之间的转化可能不属于基本反应类型
【解析】A选项,判断氧化还原反应的依据是元素的化合价是否发生变化,与是否有单质参与反应没有直接联系。有单质参加的反应不一定是氧化还原反应,如同素异形体之间的转化(氧气与臭氧、白磷与红磷、金刚石与石墨)是非氧化还原反应;氧化还原反应中不一定有单质参与,如┒氧化氮溶于水,A选项错误。B选项,二氧化硅可与氢氟酸反应,B选项错误。能与溴水反应的有机物除含有碳碳双键或碳碳叁键的有机物外,还有醛类、酚类等,C选项错误。浓硫酸、浓硝酸与硫化氢等之间的反应不属于基本反应类型,二氧化氮与氢氧化钠溶液反应、碳单质与浓硫酸、浓硝酸等之间的反应都不属于基本反应类型,D选项正确。答案:D
【通性通法】对于一些概念式、命题式判断类问题,可以采用列举特例法或反例法判断,这就要求在学习中,不仅要掌握一般规律,而且还要熟悉一些特殊例证,例证越丰富,解这类题就越快越准。
技巧2 巧用假设,以静制动
在解答有关四大平衡(化学平衡、电离平衡、水解平衡、沉淀溶解平衡)移动问题时,有时会出现多因素(如温度、浓度或压强)的影响,针对这类问题,可以采用假设法,先假设其他因素不变,判断第一个因素变化对结果产生的影响,然后再判断第二个因素变化对结果产生的影响,进而得出正确答案。
例题2 常温下,硫化氢水溶液中存在:H2SH++HS-,HS-H++S2-,下列推断合理的是( )
A.向硫化氢溶液中加水稀释,
逐渐变小
B.向硫化氢溶液中加入少量固体硫酸铜粉末(不考虑体积变化),溶液中所有离子的浓度都减小
C.向硫化氢溶液中加入少量(NH4)2S固体,平衡向左移动,
增大
D.在硫化氢溶液中加水稀释,
不变
【解析】
是H2S的一级电离平衡常数(Ka1),Ka1是温度函数,温度不变,其值不变,A项错误;B项,加入固体硫酸铜粉末生成硫化铜沉淀,促进电离平衡向右移动,H+浓度增大,B项错误;加入硫化铵,S2-浓度增大,平衡向左移动,溶液中H+浓度减小,达到新平衡时,S2-浓度比原平衡时浓度大,故
增大,C项正确;假设稀释时平衡不移动,H+、S2-、H2S浓度同倍数变化,
不变;实际上,稀释促进电离,S2-浓度增大,H2S浓度减小,
减小,D项错误。答案:C
【通性通法】对于化学平衡体系,若改变体积,判断某成分浓度的变化,先假设改变体积时平衡不移动,判断体积改变时导致浓度变化,与题目条件对照,然后判断平衡移动的方向。例如,某气体反应平衡中,若生成物A的浓度为c(A)=0.5 mol/L,体积扩大至2倍,达到新平衡时c(A)=0.3 mol/L,若平衡不移动,则体积扩大至2倍,A的浓度为0.25 mol/L<0.3mol/L,说明平衡向正反应方向移动,若忽视体积变化,易错误判断平衡向逆反应方向移动。
技巧3 抓住恒等 区别离子
在电解质溶液中,部分同学分不清水电离的离子与电解质电离的离子,对解这类题目感到很困惑。如果抓住水电离的H+与OH-浓度恒等,辨析离子来源,就容易突破这类题目。即先写出溶液中所有的电离平衡、水解平衡方程式,包括水电离平衡方程式,然后分析离子来源,从中找到离子浓度之间的相关联系。
例题3 25℃时,在等体积的 ①pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
【解析】由水电离的H+浓度等于由水电离的OH-浓度。
① pH=0的H2SO4溶液中c(H+)=1mol/L,OH-来自水的电离:c(OH-)=1×10-14mol/L;
②Ba(OH)2溶液中H+来自水的电离:c(OH-)=0.1mol/L,c(H+)=1×10-13mol/L。
③S2-+H2OHS-+OH-,由水电离的OH-和H+相等,但是有一部分H+与S2-结合,溶液中OH-浓度等于水电离的OH-浓度:c(H+)=1×10-10mol/L,c(OH-)=1×10-4mol/L。答案:A
【通性通法】1.H+或OH-来源:酸溶液中OH-来自水的电离,H+来自酸电离和水电离的H+之和;碱溶液中H+来自水的电离,OH-来自于碱电离和水电离的OH-之和;能水解的盐溶液中OH-和H+都来自于水,只是一部分被盐电离的离子“消耗”了。例如,25℃时,pH=5的氯化铵溶液中,铵根离子消耗OH-,所以,水电离的H+浓度为1×10-5mol/L,而不是1×10-9mol/L。2.近似处理规则:当酸电离的H+浓度是水电离的H+浓度的100倍及以上时,可以忽略水电离的H+,近似计算pH。碱的溶液作相似处理。
技巧4 识别图像 紧抓原理
化学反应速率和化学平衡图像一直高中化学的是重点和难点,解这类题的关键是准确认识图像,抓住原理与图像关系解题。图像主要包括化学反应速率与时间,浓度与时间,浓度(或转化率)与温度、压强等图像,首先看清楚图像表示什么(横坐标、纵坐标表示含义),然后抓住点、线、面之间的关系,如果有数据,一定要看清楚数据与点之间的对应关系,最后再根据图像分析解答。
例题4已知反应:2CH3COCH3(l)CH3COCH2COH(CH3)-2(l)。取等量CH3COCH3,分别在0℃和 20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是( )
A.b代表0℃下CH3COCH3的Y-t曲线
B.反应进行到20 min末,CH3COCH3的C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
【解析】其他条件相同时,温度越高,反应越快,达到平衡所用时间越短,根据图像知,曲线b先达到平衡,说明b代表的20℃下CH3COCH3的Y-t曲线;温度升高,反应速率加快;由图像可知,曲线b平衡时的转化率低,表明温度升高,转化率降低;a曲线和b曲线的相交点是(66,0.113),在该点丙酮的转化率相等,也即产物的量相等,即物质的量变化值相等。答案:D
【通性通法】 突破化学平衡图像题宜采用三步曲:第一步,识图像。识别图像纵坐标和横坐标表示什么,曲线、点、平台的含义及变化趋向,及图像中的数据变化等;第二步,用原理。有关化学原理主要有影响化学反应速率因素和化学平衡移动的因素,化学反应速率和化学平衡相关概念和规律等。第三步,找联系。将化学原理与图像信息联系起来分析、处理问题。
技巧5 抓住结构 类推性质
有机物性质主要由其所含官能团类别决定,同类官能团使有机物具有相似的化学性质,在处理有机物结构与性质关系中,可以借助教材介绍的典型有机物进行类推。有机物结构包括官能团、碳链、官能团位置之间关系以及氢原子种类数,有机物性质包括物理性质和化学性质。
例题5 叶蝉散对水稻叶蝉和飞虱具有较强的触杀作用。工业上用邻异丙基苯酚合成叶蝉散的过程如下:
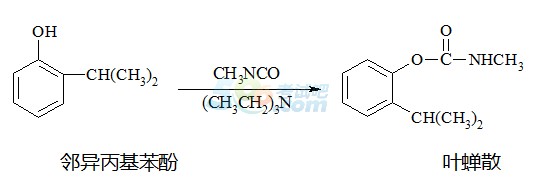
下列有关说法不正确的是( )
A.等物质的量的邻异丙基苯酚与叶蝉散在催化剂、加热条件下能消耗等物质的量的氢气
B.邻异丙基苯酚发生了取代反应转化成叶蝉散,叶蝉散能发生加成反应和氧化反应
C.叶蝉散在强酸、强碱性环境中不能稳定存在;足量的邻异丙基苯酚与碳酸钠反应不产生气体
D.检验叶蝉散中是否含邻异丙基苯酚,可选择氯化铁溶液,不能用酸性高锰酸钾溶液检验
【解析】A项,叶蝉散的化学式为C11H15NO2,在催化剂、加热条件下,苯环与氢气可发生加成反应,酯基或肽键不能与氢气发生加成反应,A项正确;B项,邻异丙基苯酚中—OH与CH3N=C=O发生了加成反应,B项错误;叶蝉散含有酯基、肽键,在酸性或碱性环境下都能发生水解反应,碳酸的酸性大于酚类的,C项正确;邻异丙基苯酚含有酚羟基,遇氯化铁溶液变紫色,叶蝉散能使酸性高锰酸钾溶液褪色,D项正确。答案:B
【通性通法】(1)中学重要的官能团和主要性质:
官能团重要反应代表物
碳碳双键加成反应、氧化反应和加聚反应乙烯
碳碳叁键加成反应、氧化反应和加聚反应乙炔
醇羟基置换反应、氧化反应、消去反应和酯化反应乙醇
卤素原子水解反应、消去反应溴乙烷
酚羟基取代反应、氧化反应和中和反应苯酚
醛基还原反应、氧化反应乙醛
羧基中和反应、酯化反应乙酸
酯基水解反应乙酸乙酯
氨基中和反应氨基酸
(2)易错易混点:
①酯基在通常情况下不能与氢气发生加成反应,醛基能与氢气发生加成反应;
②酚的邻、对位取代几率比间位取代几率大,讨论消耗溴的量,不考虑间位取代,讨论同分异构体要考虑间位取代;
③卤代烃消耗条件:氢氧化钠醇溶液、加热;醇的消去条件:浓硫酸、加热。
2017高考化学选择题五大技巧(内附例题).doc
正在阅读:
[2017年内蒙古赤峰中考数学试卷及答案]2017年内蒙古赤峰中考历史真题11-22
中学教师团委书记述职报告【三篇】05-15
党课学习心得体会1000字【三篇】03-07
2017年海南卫生资格成绩查询网站:中国卫生人才网www.21wecan.com01-28
实习证明模板大全【10篇】10-12