高考化学金属及其化合物知识点总结,高考化学备考:铝及其化合物知识点+思维导图!
【#高考# 导语】©文档大全网今天给大家分享铝的重要化合物的知识点,结合思维导图,一目了然,快速get知识点~学习起来毫不费力~准备会考的同学也可以用来复习哦~~

【学习目标】
1、掌握铝的氧化物(Al2O3)、氢氧化物(Al(OH)3),及其重要盐(KAl(SO4)2)的性质;
2、正确认识氧化铝(Al2O3)和氢氧化铝(Al(OH)3)的*,会书写有关反应的化学方程式;
3、了解Al(OH)3的制备,会书写有关反应的化学方程式;
4、掌握Al3+、 Al(OH)3 、AlO2-的转化(铝三角),并能够用化学方程式或离子方程式表示。
【知识网络】

【学习内容】
一、氧化铝(Al2O3)
1、物理性质:白色固体,熔点(2054℃),沸点2980℃,难溶于水。
2、化学性质: 氧化铝难溶于水,却能溶于酸或强碱溶液中。
*氧化物(既能与强酸反应又能与强碱反应生成盐和水的氧化物)
Al2O3既能与酸反应,又能与碱反应,Al2O3是*氧化物。(金属氧化物不一定是碱性氧化物!)

3、用途
① Al2O3是工业冶炼铝的原料
② 常作为耐火材料,例如,有氧化铝坩埚。
③ 宝石的主要成分是氧化铝,各种不同颜色的原因是在宝石中含有一些金属氧化物的表现。如红宝石因含有少量的铬元素而显红色,蓝宝石因含有少量的铁和钛元素而显蓝色。
【例题】
1.下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是①NaHCO3②Al2O3③Al(OH)3④Al( )
A.③④ B.②③④ C.①③④ D.全部
2、对氧化铝的分类中正确的是 ( )
A.酸性氧化物B.碱性氧化物
C.*氧化物 D.不成盐氧化物(像CO一样)
3.下列说法正确的是 ( )
A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3能跟所有的酸碱溶液反应
D.Al2O3能跟强的酸碱溶液反应
【答案】D
【解析】Al2O3虽然难溶于水,但是2Al(OH)3 Al2O3+3H2O,Al2O3和Al(OH)3中Al的化合价相同,所以Al2O3是Al(OH)3对应的氧化物。金属氧化物与碱性氧化物是两个不同的概念,二者没有必然的联系。Al2O3是*氧化物,Al2O3与强酸、强碱反应,与弱酸、弱碱不反应。
【针对性练习】
1.除去氧化镁粉末中混有的少量氧化铝,可选用的试剂是( )
A.稀盐酸 B.稀硫酸 C.氢氧化钠溶液 D.浓氨水
2.下列关于氧化物的说法,正确的是( )
A.金属氧化物一定是碱性氧化物
B.碱性氧化物一定是金属氧化物
C.非金属氧化物一定是酸性氧化物
D.碱性氧化物都能和水反应生成相应的碱
3.有关铝和它的化合物的说法错误的是 ( )
A.用于熔化烧碱的坩埚,可用Al2O3这种材料制成
B.铝能在空气中稳定存在是因为其表面覆盖着一层保护膜
C.氧化铝是一种难熔物质,是一种较好的耐火材料
D.氢氧化铝能中和胃酸,可用于制胃药
【解析】若用Al2O3材料制成坩埚熔化烧碱,会损坏坩埚,因为两者会发生反应:Al2O3+2NaOH=2NaAlO2+H2O。
4.铝与盐酸反应的离子方程式是 ;铝与氢氧化钠溶液反应的离子方程式是 。
【解析】2Al+6H+=2Al3++3H2↑;2Al+2OH-+2H2O=AlO2-+2H2O
二、氢氧化铝(Al(OH)3)
1、物理性质:白色难溶于水的胶状沉淀,不溶于水,但能凝聚水中的悬浮物,吸附色素,用作净水剂。
2、化学性质:*氢氧化物(既能与强酸又能与强碱反应生成盐和水的氢氧化物)

【“铝三角”关系】
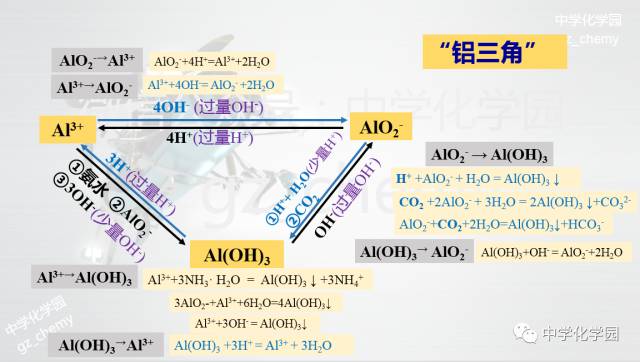
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=AlO2-+2H2O
AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
AlO2-+H++H2O=Al(OH)3↓
Al3++4OH-=AlO2-+2H2O
AlO2-+4H+=Al3++2H2O
3、Al(OH)3的制备
(1)在氯化铝溶液中加足量氨水
AlCl3+ 3NH3•H2O == Al(OH)3↓+ 3NH4Cl
Al2(SO4)3+6NH3•H2O== 2Al(OH)3↓+ 3(NH4)2SO4
离子方程式:Al3++3NH3×H2O=Al(OH)3ˉ+3NH4+
【思考】为什么不用NaOH溶液制备Al(OH)3?
向氯化铝溶液中滴加氢氧化钠溶液,现象是先有沉淀,后溶解。
Al3+ + 3OH- = Al(OH)3↓ ①
Al(OH)3+ OH-= AlO2- + 2H2O ②
总反应 :Al3++4OH- = AlO2- + 2H2O
注意:一般不用强碱是因为过量的强碱会使Al(OH)3转化为偏铝酸盐。
(2)含的NaAlO2的溶液中通入CO2气体
CO2 + 3H2O + 2NaAlO2== 2Al(OH)3↓+ Na2CO3
注意:由AlO2-制备Al(OH)3时,宜用AlO2-与CO2反应。一般不用强酸,因为过量的强酸会使Al(OH)3转化为铝盐。
4、用途
(1)是医用的胃酸中和剂的一种,它的碱性不强,不至于对胃壁产生强烈刺激或腐蚀作用,但却可以与酸反应,使胃液浓度降低,起到中和过多胃酸的作用。
(2)Al(OH)3作净水剂
5、明矾(化学式:KAl(SO4)2•12H2O)
明矾在水中能电离:KAl(SO4)2 = K+ + Al3+ + 2SO42-
明矾的净水作用:铝离子与水反应,生成的氢氧化铝胶体具有很强的吸附能力,能吸附水中的悬浮物,使之沉降以达净水目的。
复盐:两种不同的金属离子和一种酸根离子组成的化合物
光卤石:KCl.MgCl2.6H2O
(冰晶石Na3AlF6不是复盐:Na3AlF6=3Na++AlF6-)
【例题】
1.实验室制备Al(OH)3用( )
A.Al2O3和稀盐酸 B.Al2O3和水
C.Al2(SO4)3和KOH D.AlCl3和氨水
【答案】D
2.下列物质①Al②NaHCO3③Al2O3④Mg(OH)2⑤Al(OH)3中,既能与盐酸反应又能与氢氧化钠溶液反应的化合物是 ( )
A.①②③⑤ B.①④⑤
C.②③⑤ D.①③④
【答案】C
【解析】Al既能与盐酸反应,又能与NaOH溶液反应,但不是化合物;Mg(OH)2只与盐酸反应;NaHCO3、Al2O3、Al(OH)3三种物质既能与盐酸反应,又能与NaOH溶液反应。
3.下列离子方程式的书写不正确的是 ( )
A.氧化铝与盐酸反应:Al2O3+6H+=2Al3++3H2O
B.氢氧化铝与NaOH溶液反应:Al(OH)3+OH-=AlO2-+2H2O
C.向AlCl3溶液中滴加氨水:Al3++3OH-=Al(OH)3↓
D.向AlCl3溶液中加入过量NaOH溶液:Al3++4OH-=AlO2-+2H2O
【答案】C
【解析】氨水是难电离的弱碱,在书写离子方程式时,要用化学式表示,不能写成离子符号的形式。
4.下列变化不可能通过一步实验直接完成的是( )
A.Al→AlO2-
B.Al2O3→Al(OH)3
C.Al(OH)3→Al2O3
D.Al3+→AlO2-
【解析】A.Al与NaOH发生反应生成AlO2-,可以一步实现,故A不选;
B.Al2O3→Al(OH)3转化,应先生成Al3+或AlO2-后,然后加入弱碱或弱酸反应生成Al(OH)3,故B选;C.氢氧化铝受热反应生成氧化铝和水,可以一步完成,故C不选;D.铝盐与过量的强碱反应生成偏铝酸盐,可以一步完成,故D不选,故选B.
5.下列各项操作中,不发生“先沉淀后溶解”现象的是( )
A.向Ca(OH)2溶液中通入过量CO2
B.向NaAlO2溶液中滴入过量盐酸
C.向盐酸中滴入过量NaAlO2溶液
D.向Al(SO4)3溶液中滴入过量NaOH溶液
【解析】A.向Ca(OH)2溶液中通入过量的CO2,发生的反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O、CaCO3+CO2+H2O=Ca(HCO3)2,所以发生“先沉淀后溶解”现象,故A不选;
B.向NaAlO2溶液中滴入过量的盐酸,发生的反应方程式为:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl、
Al(OH)3+3HCl=AlCl3+3H2O,所以发生“先沉淀后溶解”现象,故B不选;
C、盐酸中滴加偏铝酸钠,开始盐酸会和偏铝酸钠溶液反应生成氯化铝,随着偏铝酸钠的滴加,氯化铝还可以和偏铝酸钠反应生成氢氧化铝,所以开始无沉淀,最后出现沉淀,沉淀最终不溶解,故C正确;
D.向Al2(SO4)3溶液中滴入过量的NaOH溶液发生的化学反应方程式为:
AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,所以发生“先沉淀后溶解”现象,故D不选;故选C.
6.下列各组物质,前者逐滴滴加到后者中直至过量,先出现白色沉淀,后来沉淀又消失的是( )
A.HCl滴入NaAlO2溶液中
B.Ba(OH)2溶液滴入Al2(SO4)3溶液中
C.AlCl3溶液滴入NaOH溶液中
D.氨水滴入AlCl3溶液中
【解析】A、偏铝酸钠溶液中滴入盐酸,先生成氢氧化铝沉淀,继续滴加氢氧化铝溶解,反应的离子方程式为AlO2-+H++H2O=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2O,故A符合;
B、硫酸铝溶液中滴入氢氧化钡溶液过程中一定有硫酸钡沉淀生成,会出现沉淀减少但不会出现沉淀全部溶解消失的现象,故B不符合;
C、氢氧化钠溶液中滴入氯化铝溶液,开始无沉淀生成,继续滴加生成沉淀氢氧化铝,反应的离子方程式为,Al3++4OH-=AlO2-+H2O,3AlO2-+Al3++6H2O=4Al(OH)3↓,故C不符合;
D、氯化铝溶液中滴入氨水溶液,过程中有沉淀生成,氢氧化铝不溶于过量氨水,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;故D不符合;故选A.
高考化学备考:铝及其化合物知识点+思维导图!.doc
正在阅读:
2019浪漫的七夕红包祝福语03-21
2016年《开学第一课》节目:执着篇02-13
未来的学校作文400字02-03
人教版小学四年级上册语文教案:火烧云03-15
2017年12月新疆乌鲁木齐证券业从业资格考试时间为12月2日至3日03-15
伟大的祖国演讲稿800字05-09
小学生寒假记事作文400字02-04