2017河南中考化学试题及答案解析(图片版)-2017年河南中考化学试题及答案(化学方程式的书写及计算)

化学方程式的书写及计算
一、选择题
1.根据化学方程式不能获得的信息是(B)
A.该反应中的反应物和生成物
B.化学反应的快慢
C.反应发生所需要的条件
D.参加反应的各粒子的相对数量
2.(2016,衡阳)FeS2常用于在接触法制硫酸过程中产生SO2,其化学方程式为:4FeS2+11O2高温(=====) 2X+8SO2,则X的化学式为(B)
A.FeO B.Fe2O3 C.Fe3O4 D.FeSO4
3.(2015,河南)工业制镁的方法为:将含碳酸钙的贝壳制成石灰乳;在海水中加入石灰乳,过滤;在氢氧化镁中加入盐酸,结晶;电解熔融氯化镁。该方法中的化学反应不包括(B)
A.化合反应 B.置换反应
C.分解反应 D.复分解反应
4.(2015,成都)按下表进行实验,有关说法及分析错误的是(D)
|
|
向少量NaOH溶液中滴加CuSO4溶液 |
向少量BaCl2溶液中滴加CuSO4溶液 |
|
现象 |
① |
白色沉淀 |
|
|
| |
|
方程式 |
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4 |
② |
A.①有蓝色沉淀
B.②反应的化学方程式为CuSO4+BaCl2===BaSO4↓+CuCl2
C.两个反应都属于复分解反应
D.只要有沉淀生成的反应就属于复分解反应
5.(2016,宜宾)下列化学方程式及反应类型均正确的是(D)
|
|
化学方程式 |
反应类型 |
|
A |
CO+O2=== CO2 |
化合反应 |
|
B |
2KMnO4△ K2MnO2+MnO2+2O2↑ |
分解反应 |
|
C |
2Ag+H2SO4=== Ag2SO4+H2↑ |
置换反应 |
|
D |
CuSO4+BaCl2=== CuCl2+BaSO4↓ |
复分解反应 |
6.(2015,宜宾)用CO2和NH3合成尿素[CO(NH2)2]是固定和利用CO2的成功范例。化学反应方程式为CO2+2NH3一定条件(=====)CO(NH2)2+H2O,下列说法正确的是(C)
A.上述反应共涉及到三种氧化物
B.C、H、O、N四种元素均位于周期表第二周期
C.尿素含氮量高,是一种很好的氮肥
D.尿素中含有CO分子
7.(2016,永州)将16 gA和足量B混合加热,A与B发生化学反应,16 gA完全反应后生成12 gC和8 gD,则参加反应的A与B的质量比是(D)
A.1:1 B.2:1 C.3:1 D.4:1
8.(2016,广安)物质X在4.8 g氧气中恰好完全燃烧,反应方程式为X+3O2点燃(=====) RO2+2SO2,测得RO2和SO2的质量分别为2.2 g和6.4 g,下列判断中正确的是(B)
A.参加反应的X的质量为4.3 g
B.X的相对分子质量为76
C.X中含有R元素、S元素、O元素
D.产物为气态时都是空气污染物
9.(2015,遵义)质量守恒定律是帮助我们认识化学反应实质的重要理论,在化学反应aA+bB===cC+dD中,下列说法正确的是(D)
A.化学计量数a和b之和一定等于c与d之和
B.若A和C都是盐,则该反应一定是复分解反应
C.反应物A和B的质量比一定等于生成物C和D的质量比
D.若取x g A和x g B反应,生成C和D的质量总和不一定等于2x g
10.(2016,泸州)向5.6 g铁中加入200 g硫酸溶液,铁与硫酸溶液恰好完全反应,下列有关说法正确的是(C)
A.反应后溶液中的溶质是Fe2(SO4)3
B.反应后溶液中SO4(2-)质量是9.8 g
C.原硫酸溶液的溶质质量分数是4.9%
D.反应后溶液的质量是205.5 g
11.(2016,扬州)以FeSO4为原料制备铁黑颜料Fe3O4(其中Fe既有+2价,也有+3价)的过程如图:
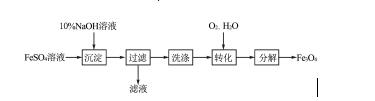
“转化”过程的反应为:4Fe(OH)2+O2+2H2O=== 4Fe(OH)3。若原料中含FeSO49.12 t,下列说法正确的是(C)
A.理论上与FeSO4反应的NaOH溶液的质量为4.8 t
B.理论上“转化”过程中参与反应的O2的质量为320 kg
C.该方法理论上最终可以获得Fe3O4的质量为4.64 t
D.若“转化”过程中参与反应的O2过量,则最终所得固体的质量偏小
二、简答题
12. (2014,河南) 用化学方程式表示下列反应原理。
(1)用电解水的方法制取氢气。
__2H2O通电(=====)2H2↑+O2↑__
(2)用磁铁矿(含Fe3O4)炼铁。
__4CO+Fe3O4高温(=====)3Fe+4CO2__
(3)实验室制取氧气。(写出一个即可)
__2KMnO4△(=====)__K2MnO4+MnO2+O2↑(或2H2O2MnO2(=====)2H2O+O2↑等)__
13.(2014,河南)在充满CO2的铝制易拉罐中加入过量NaOH溶液后封口,易拉罐立即变瘪,原因是__CO2气体能与NaOH溶液反应而被吸收,使罐内气压减小__;一会儿易拉罐又鼓起,因Al与NaOH溶液反应生成H2和NaAlO2,该化学方程式为__2A1+2NaOH+2H2O (=====)2NaA1O2+3H2↑__。
14.(2016,河南化学竞赛)醋酸(CH3COOH)是一种常见的酸,具有酸的通性。例如:醋酸与氢氧化钠溶液反应生成醋酸钠和水,化学方程式为:CH3COOH+NaOH===CH3COONa+H2O。
(1)氢氧化钾与氢氧化钠一样,也是一种常见的碱,具有碱的通性。请写出醋酸与氢氧化钾溶液发生中和反应生成的盐的化学方程式。
__CH3COOH+KOH (=====)CH3COOK+H2O__
(2)醋酸与盐酸一样,能与活泼金属反应生成氢气。请写出醋酸与金属锌反应的化学方程式__2CH3COOH+Zn (=====)(CH3COO)2Zn+H2↑__。
三、计算题
15.(2016,雅安)取氯酸钾和二氧化锰的混合物13 g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为8.2 g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失),计算:
(1)生成氧气的质量;
(2)参加反应的氯酸钾的质量(写出计算过程);
(3)氯化钾溶液的质量(写出计算过程)。
解:(1)生成氧气的质量:13 g-8.2 g=4.8 g
(2)设参加反应的氯酸钾的质量为x。
2KClO3MnO2 2KCl+3O2↑
245 96
x 4.8 g
96(245)=4.8 g(x) x=12.25 g
(3)氯化钾的质量:12.25 g-4.8 g=7.45 g
氯化钾溶液的质量:10%(7.45 g)=74.5 g
16.(2016,宜昌)某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,称取5 g样品,加入27 g水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH。当pH=7时,刚好用去10%的稀盐酸36.5 g。试计算:
(1)将100 g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需加水的质量为__280__g。
(2)样品中氢氧化钠的质量分数。
(3)反应后所得溶液中溶质的质量分数。
(2)解:设样品中NaOH的质量为x,生成NaCl质量为y。
NaOH+HCl===NaCl+H2O
40 36.5 58.5
x 36.5 g×10% y
x(40)=36.5 g×10%(36.5)=y(58.5)
x=4 g y=5.85 g
样品中氢氧化钠的质量分数=5 g(4 g)×100%=80%
反应后溶液中溶质的质量分数=5 g+27 g+36.5 g(5.85 g+5 g-4 g)×100%=10%
答:样品中氢氧化钠的质量分数为80%,反应后所得溶液中溶质质量分数为10%。
2017年河南中考化学试题及答案(化学方程式的书写及计算).doc正在阅读:
2017年河南中考化学试题及答案(化学方程式的书写及计算)06-26
2019年1月雅思报考网站:https://ielts.neea.cn/或https://ielts.neea.edu.cn/01-29
2017年初级经济师考试大纲:运输经济(民航)专业知识与实务01-24
高中数学学习方法经验09-05
2022年下半年湖南常德中小学教师资格认定补充公告10-19
2019年党支部年度工作计划:人事经理2019年度工作计划08-31
2016四川南充中考政治试题及答案03-25
2017海南中药学职称考试成绩单打印入口【已开通】02-16
二年级小学生重阳节手抄报文字内容09-28
江西上饶银行2017校园招聘公告04-02
周岁生日庆典主持词结尾09-16