高考化学工业流程题技巧|高考化学工业流程解题思路+真题
【#高考# 导语】水滴石穿,绳锯木断。学习,也需要一点点积累才能到达好的效果。®文档大全网为您提供高考化学工业流程解题思路+真题,通过做题,能够巩固所学知识并灵活运用,考试时会更得心应手。快来练习吧!

重要的化学工业:
侯氏制碱法、海水中提取镁、溴、碘等、铝土矿中提取铝、金属的冶炼、硫酸工业、*工业、合成氨工业、硅酸盐工业、氯碱工业、煤的综合利用。
一、化工流程图的一般模式
工业流程题目在流程上一般分为三个过程:原料处理→分离提纯→获得产品
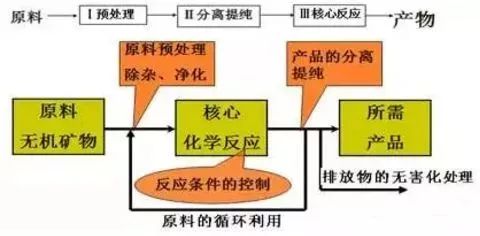
要点诠释:
1、规律:主线主产品,分支副产品,回头为循环。
2、核心考点:物质的分离操作、除杂试剂的选择、生成条件的控制等。
3、原料预处理(初步分离)
(1)起到富集反应物的作用:
在无机题中,原材料是一种混合物,可能是矿石、某工厂废料或发生变质的材料等,整个实验过程或反应流程就是分离提纯,想办法提取有效元素。
(2)工业流程常见的操作与名词:
①研矿:增大接触面积,使反应充分,提高反应速率
②溶解:通常用酸溶,如用硫酸、盐酸、浓硫酸等(有时可用碱溶,如铝矿溶解)。
水浸:与水接触反应或溶解。
浸出:固体加水(酸)溶解得到离子浸出。
浸出率:固体溶解后离子在溶液中的含量的多少(更多转化) 。
酸浸:在酸溶液中反应使可溶性金属离子进入溶液,不溶物通过过滤除去的溶解过程。
③焙烧、灼烧或煅烧(结构改变更易溶解浸出;使一些杂质高温下氧化、分解)
吹出(利用空气吹出溶液中的气体)
④调pH值除杂:控制溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀。
4、中间产品、终极产品的分离提纯
(1)物理方法:溶解过滤、水洗、结晶、蒸馏 、萃取分液、升华、液化、盐析、渗析法 、电渗析、离子交换、吸附法、浮选法
(2)化学方法:热分解法,酸、碱处理法,沉淀法 ,氧化还原法、电解法
二、考查知识点
(1)反应速率与平衡理论的运用;
反应物颗粒大小:反应速率、原料的利用率等
温度:反应速率、物质的稳定性、物质的结晶等
(2)氧化还原反应的判断、化学方程式或离子方程式的书写;
(3)利用控制pH分离除杂;
(4)化学反应的能量变化(热化学方程式的书写);
(5)实验基本操作:除杂、分离、检验、洗涤、干燥等;
(6)流程中的物质转化和循环,资源的回收和利用;
(7)环境保护与绿色化学评价。
三、分析流程题需要的一般思路
流程类试题的结构分题头、题干和题尾三部分。题头一般是简单介绍实验目的和原理或工艺生产的原材料和工艺生产的目的(包括附产品);题干部分主要用框图形式将操作或物质转换或原料到产品的主要生产工艺流程表示出来;题尾主要是根据流程中涉及到的化学知识设制成系列问题,构成一道完整的化学试题。
解答流程题的一般思路是:
浏览全题,确定该流程的目的,看懂生产流程图;了解流程图以外的文字描述、表格信息、后续设问中的提示性信息,并在下一步分析和解题中随时进行联系和调用;解析流程图并思考从原料到产品依次进行了什么反应,利用了什么原理。每一步操作进行到什么程度,每一步除目标物质外还产生了什么杂质或副产物,杂质或副产物是怎样除去的等等。要抓住一个关键点:一切反应或操作都是为获得产品而服务。
解答流程题要注意的问题是:
注意化学方程式的书写,反应物、产物的分子式书写要正确;化学方程式要配平,电极反应式和化学方程式一定要书写正确;等号或可逆符号不能少;沉淀、气体、固态、水溶液等符号要标明。注意评价或比较实验方案要全面,反应物种类多少、是否易得、是否对环境有污染;反应产物的种类多少,对目标产物的分离和提纯是否有影响;反应条件是否苛刻;仪器、设备是否要求高;工艺流程、实验步骤的多少。注意描述语言的规范性和准确性,从化学原理的角度、用化学语言作答;要抓住主要问题,针对具体问题作具体分析;要看清题目要求,按要求答题。
【高考真题】
【2015·山东】(19分)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
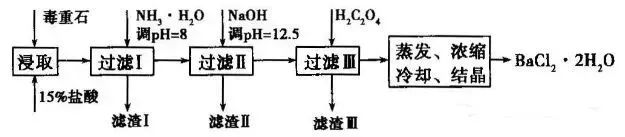
(1)毒重石用盐酸浸取前需充分研磨,目的是_____。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的_____。
a.烧杯 b.容量瓶
c.玻璃棒 d.滴定管
(2)
Ca2+ |
Mg2+ |
Fe3+ |
|
开始沉淀时的pH |
11.9 |
9.1 |
1.9 |
完全沉淀时的pH |
13.9 |
11.1 |
3.2 |
加入NH3·H2O调节pH=8可除去_____(填离子符号),滤渣Ⅱ中含_____(填化学式)。加入H2C2O4时应避免过量,原因是______。已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H20
Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的_____(填“上方”或“下方”)。BaCl2溶液的浓度为______mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将______(填“偏大”或“偏小”)。
【答案】(1)增大接触面积从而使反应速率加快;ac
(2)Fe3+;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少。
(3)上方;(V0b—V1b)/y;偏小。
【解析】(1)充分研磨可以增大反应物的接触面积,增大反应速率;因为配制的盐酸溶液浓度为质量分数,可以计算出浓盐酸的体积和水的体积,所以使用烧杯作为容器稀释,玻璃杯搅拌。
(2)根据流程图和表中数据,加入NH3•H2O调pH为8,只有Fe3+完全沉淀,故可除去Fe3+;加入NaOH调pH=12.5,Mg2+也完全沉淀,Ca2+部分沉淀,所以滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;根据Ksp(BaC2O4)=1.6×10-7,H2C2O4过量时Ba2+转化为BaC2O4沉淀,BaCl2·2H2O产品的产量减少。
(3)“0”刻度位于滴定管的上方;与Ba2+反应的CrO42-的物质的量为(V0b—V1b)/1000mol,则Ba2+浓度为(V0b—V1b)/y;根据计算式,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,V1减小,则Ba2+浓度测量值将偏大。
【考点】本题通过化学流程的分析,考查了基本操作和基本仪器、离子的去除、溶液的配制和酸碱中和滴定,包含了实验数据的分析和处理、和误差的分析。
高考化学工业流程解题思路+真题.doc正在阅读:
高考化学工业流程解题思路+真题09-02
2017年辽宁鲅鱼圈事业单位招聘考试真题及答案解析(Word版)10-07
走过那条路作文900字11-04
幼儿园春游活动总结2022【五篇】05-14
高二数学向量重点学习方法04-14
2017湖北猇亭区中小学教师招聘公告12-30
iPhone屏幕卡住了怎么办?iPhone屏幕无响应解决办法06-10
妈妈的爱作文800字07-03
回到从前作文500字07-31
精选坐月子食谱建议06-13